Comment les pattes poussent aux animaux, et les membres aux humains
Par Vincent Fleury, Université Paris Diderot
L’ambition de la médecine régénératrice est de remplacer des parties du corps absentes ou défaillantes par une « pièce de rechange » aussi fonctionnelle et saine que l’organe ou membre d’origine. Cet espoir se fonde sur un grand nombre de cas de régénération observés spontanément dans la nature : chez beaucoup d’invertébrés, et quelques vertébrés tels le triton ou le lézard, les pattes, la queue, ou même toute une partie du corps peut se régénérer.
Chez l’homme, la peau, le foie, les cheveux « repoussent », mais quant aux membres, seule la dernière phalange se régénère spontanément en cas d’amputation.
Il va de soi que de nombreux malades ou accidentés seraient heureux de retrouver un doigt, une main ou un bras entier fonctionnel. On a vu récemment des cas mystérieux d’enfants nés sans bras, on aimerait évidemment pouvoir faire quelque chose pour eux.
Dans cette perspective, il existe, en gros, trois approches scientifiques ou technologiques pour ce que l’on appelle l’ingénierie des tissus. La première consiste à faire une sorte de maquette en polymère de l’organe défaillant et à l’ensemencer avec les cellules souches de la partie en question. La seconde consiste à essayer d’imprimer en 3D ces organes, à l’aide d’« encres » constituées de milieu de culture contenant les cellules souches de l’organe à reproduire. Pour l’instant, les essais de ce type se sont limités à des cas simples comme des urètres ou des vessies de formes peu complexes, sans enchevêtrements, branchements ou segmentations, avec un nombre très limité de types cellulaires.
Redémarrer le programme physiologique
La troisième méthode consiste à essayer de stimuler le tissu pour qu’il refasse, par ses propres moyens, un organe identique remplaçant l’organe ou membre lésé. Il s’agit de redémarrer le « programme » physiologique. Des recherches dans ce domaine ont permis de faire croître des formes complexes comme des morceaux de rein ou de poumon. Pour aller plus loin, il faut une connaissance très précise, sinon exacte, de la façon dont les organes ou membres se forment dans le cas « normal ».
C’est pourquoi depuis plusieurs années, notre laboratoire et d’autres dans le monde, se sont attelés à comprendre les mécanismes de morphogénèse à l’œuvre lors du développement de l’embryon d’un être vivant : comment sont faits, exactement, les animaux et l’homme ?
Une série de résultats nouveaux est ainsi venue bouleverser la vision classique de l’embryogénèse : à tel point que l’on peut intervenir aujourd’hui sur certaines phases du développement embryonnaire et provoquer, avec des outils électrotechniques, des accélérations du processus allant jusqu’à un facteur 20, jusque parfois un facteur 100 !
Ces recherches ouvrent un champ immense d’intervention, avec des outils d’ingénieur, en embryologie et potentiellement en médecine régénératrice. La perspective se dessine de pouvoir un jour disposer de sortes de machines à tricoter qui pourraient stimuler le tissu à bon escient et ainsi accélérer ou déclencher la morphogénèse de certaines parties du corps.
Sur un plan fondamental, ces découvertes expliquent comment sont faits les animaux, et ce qu’ils sont exactement. Si l’on considère le vivant d’un point de vue physique, ils sont ce que l’on nomme en physique des attracteurs d’un système dynamique : les animaux procèdent d’un mouvement d’étirement et de pli. Si l’on se place dans une perspective évolutionniste, on peut considérer qu’à l’origine des animaux, il y a un réflexe, une sorte de crampe, d’une masse molle qui se déforme jusqu’à devenir quelque chose de moins déformable qu’on appelle un animal.
Les forces mises en œuvre pour déformer la masse initiale sont les mêmes que celles qui servent à l’être final à se mouvoir et à digérer. Le « patron » de base du vertébré, ensemble de tubes emboîtés qui se déplacent (tube nerveux, corps, tube digestif) est un objet physique compréhensible par les lois de la matière condensée dite « active ».
Expliquons alors, simplement, comment on comprend la formation d’animaux tels que les poissons, les oiseaux ou l’humain. Initialement, les femelles pondent des œufs qui sont des cellules énormes. Après fécondation, ces cellules se divisent sans augmentation de masse (dans la plupart des cas). Contrairement à une idée répandue, la formation d’un animal n’est pas vraiment une question de croissance, mais plutôt une question de réorganisation de la masse initiale. La nature doit se débrouiller avec l’ovule fécondé, pour en faire un animal complet.
Donc cette masse ronde et molle se divise comme le montre la figure ci-dessous.
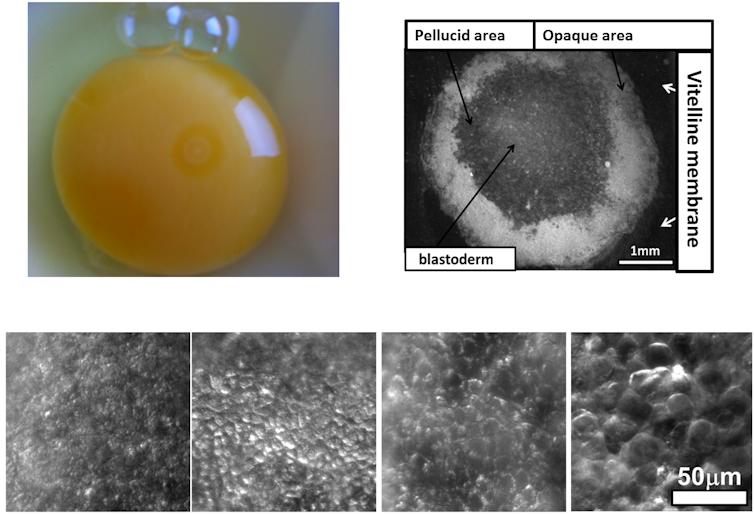
La masse se divise de façon rythmée. Elle devient progressivement une galette, constituée de ronds concentriques, un peu comme des cernes d’arbres, mais très molles : les embryons ont la consistance de la gelée de méduse. Les forces qui s’exercent dans cette masse embryonnaire sont particulières : chez les animaux, la morphogénèse se déploie par des forces exercées le long de minuscules filaments qui exercent des tractions comme on tirerait sur des haubans. Cette force filamentaire est la même que celle qui permet le mouvement des membres, tirés ou fléchis par leurs fibres musculaires et leurs tendons. La force s’exerçant pendant l’embryogénèse est donc de même nature que la force musculaire. Elle se déploie par l’intermédiaire de polymères (actine/myosine). Ainsi, l’embryogénèse peut-être vue comme une sorte de sport ou d’exercice physique primitif fait par ce qui n’est pas encore un animal…
Un animal est formé de tubes emboîtés
De même que les embryons, les proto-muscles de l’embryon ont également une structure en anneaux concentriques. Les cellules contractiles ont une organisation en ceintures ou lacets ou encore en « cordons de porte-monnaie », mais emboîtés. Chaque anneau, et chaque lacet va participer à la construction d’une partie du corps : le disque central va devenir le tube nerveux, le premier anneau la peau dorsale, l’anneau suivant la peau ventrale, l’anneau d’après le tube digestif, et l’anneau suivant le chorion et l’amnios (la poche des eaux), comme le montre le schéma ci-dessous.
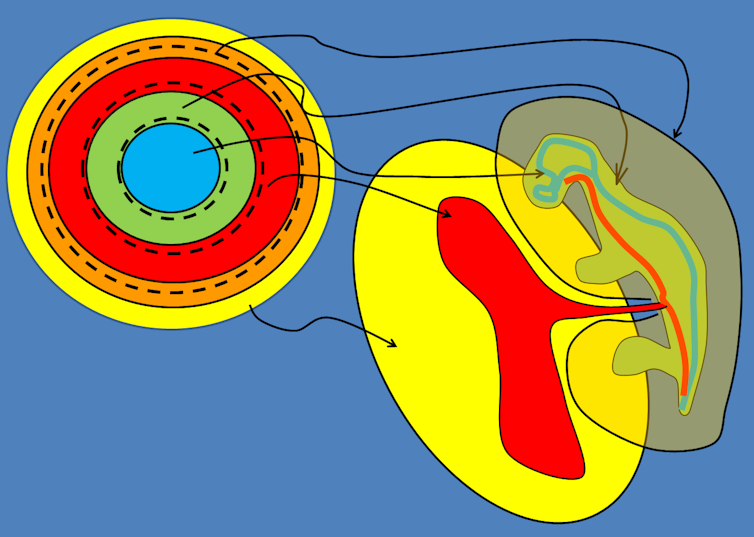
Le mécanisme de transformation de la succession d’anneaux emboîtés en un animal est très simple : les anneaux sont mous, et en faisant leur premier exercice, ils s’infligent à eux-mêmes une déformation. Or quand un lacet rond se contracte, il referme son anneau sur lui-même en cylindre, un peu comme une « calzone » par rapport à une pizza (figure ci-dessous).

Une succession d’anneaux emboîtés, et contractiles, se referme donc en une succession de tubes emboîtés comme des poupées russes. Ce système de tubes emboîtés est moins déformable que la masse ronde initiale, et forme ce qu’on appelle en physique un « attracteur » de la dynamique. De plus, la force qui a servi à créer ce système de tubes emboîtés est disponible pour faire avancer le tube (contractions en anneaux, dites « péristaltiques »), et le tube interne saura automatiquement digérer en sens inverse puisque, en vertu de la symétrie dedans/dehors, si l’animal avance dans le sens de la tête, il digère en sens inverse. Ainsi, la succession d’anneaux emboîtés mous, devient par le truchement de la même force physique, exercée autant de fois qu’il y a d’anneaux, un animal formé de tubes emboîtés, qui avancent et digèrent.
Stimuler électriquement le développement des membres
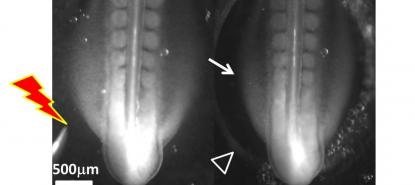
La dernière découverte faite par notre groupe, que nous avons publiée en août, est que ces forces sont excitables, comme l’est le mouvement de nos bras. Ainsi, de même qu’un choc électrique peut provoquer un mouvement très brutal de nos membres, une décharge exercée au bon moment, au bon endroit, et avec la bonne intensité, peut accélérer énormément les contractions morphogénétiques de l’embryon.
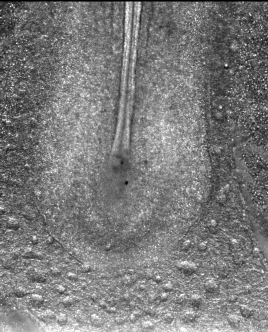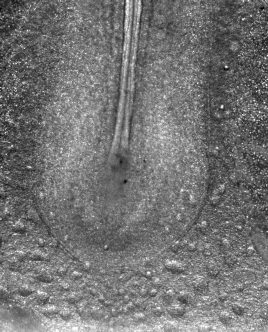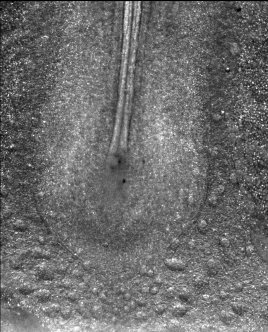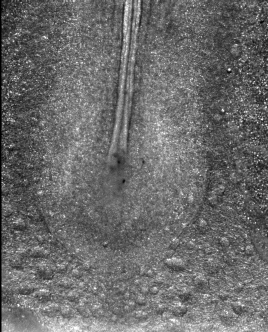
En approchant une minuscule électrode (0,05 mm) sur un embryon de cinq ou six millimètres, et en appliquant une tension de 0,1 à 1 V, on peut provoquer une accélération d’un facteur 10 à 100 du développement embryonnaire. Dans notre laboratoire, nous avons testé ces électrocutions ciblées de l’embryon, à tous les stades entre la « blastula » et la formation des pattes, et avons été en mesure d’accélérer systématiquement toutes les étapes du développement précoce, notamment la formation des précurseurs des pattes.
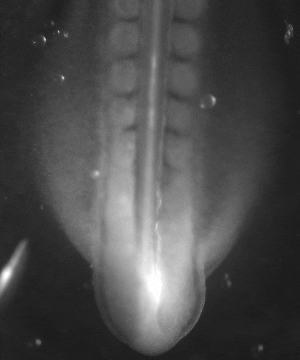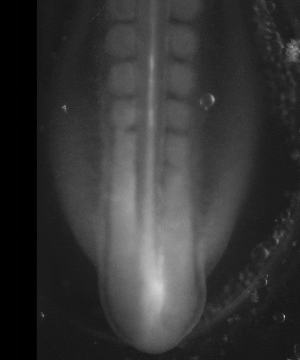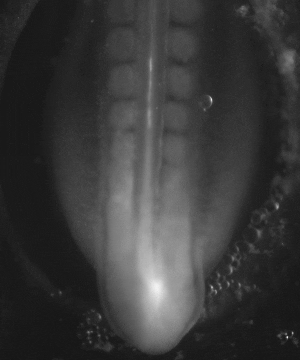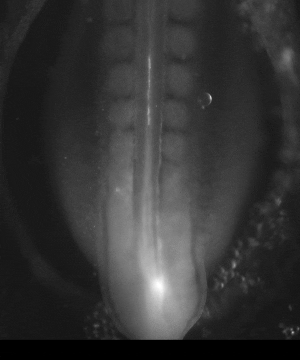
On peut se demander si en stimulant électriquement les tissus de façon chronique on pouvait accélérer globalement le développement d’un facteur 10 à 100 ; ce n’est pas du tout impossible, puisqu’on sait que, dans la nature, il existe déjà des différences pratiquement d’un facteur 500 entre les développements les plus rapides et les plus lents, observés chez des espèces différentes.
On comprend ainsi que la stimulation électrique puisse considérablement accélérer le développement. On sait très bien, depuis les années 1780 et les travaux de Luigi Galvani qu’en stimulant électriquement le pattes d’une grenouille décapitée, on provoque des mouvements réflexes violents, semblables aux mouvements volontaires.
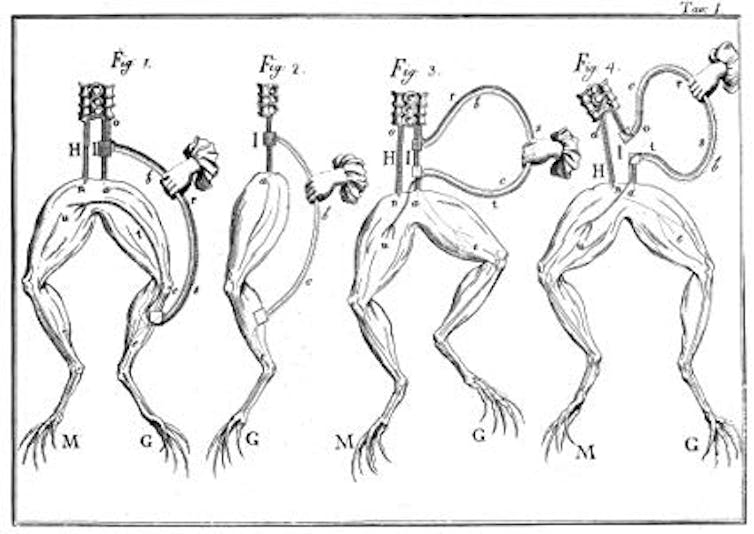
Une fois que l’on a compris que la morphogénèse n’est rien d’autre qu’une sorte d’exercice physique sur une masse informe, qui s’inflige à elle-même une déformation embryogénétique, on comprend bien que la formation de l’animal soit accélérée par des chocs électriques : un animal « fait », remue brutalement quand on l’électrocute, un animal « pas encore fait » se fait brutalement quand on l’électrocute.
Dans les deux cas, la force réellement disponible dans les cellules est bien plus grande que la force exploitée ordinairement. La sensibilité aux chocs électriques provient d’un fait aujourd’hui bien établi, à savoir que la tension dans les fibres musculaires est contrôlée par des flux d’ions calcium qui sont sensibles à la polarité électrique de la membrane cellulaire.
La découverte que la morphogénèse normale d’une patte, dans la phase de mise en place, peut être contrôlée et même accélérée énormément avec des outils dédiés et bien mis en place suivant une démarche scientifique précise, démontre d’une part que la formation d’un animal est maintenant comprise, et d’autre part qu’il existe un réel espoir de déclencher de novo la formation d’organes, avec des outils d’ingénieur. Sur le plan intellectuel, elle suggère que la formation des animaux est une sorte de réflexe automatique d’une masse molle, fabriquant toutes ses parties avec autant de crampes qu’il y a d’anneaux dans la masse, ce qui secoue les connaissances admises en matière d’évolution.![]()
Vincent Fleury, Directeur de recherche, Laboratoire Matière et systèmes complexes, Université Paris Diderot
Cet article est republié à partir de The Conversation sous licence Creative Commons. Lire l’article original.