La flunarizine pour traiter l’amyotrophie spinale ?
Une équipe de chercheurs de l’Inserm (INSERM UMR 1124 « Toxicologie, pharmacologie et signalisation cellulaire ») et des universités Paris Descartes et Paris Diderot (Laboratoire de Biologie Cellulaire des Membranes, Institut Jacques Monod), vient de découvrir qu’un médicament déjà utilisé contre la migraine et l’épilepsie, la flunarizine, permet de réparer un défaut moléculaire lié à l’amyotrophie spinale, maladie grave et incurable.
Ce travail est l'aboutissement de recherches menées depuis 1995, lorsque l’équipe Inserm à laquelle appartenait Suzie Lefebvre, directrice des travaux publiés aujourd’hui, est parvenue à identifier le gène responsable de l'amyotrophie spinale infantile. Les résultats des premiers essais chez l’animal, parus dans Scientific Reports, se révèlent extrêmement prometteurs avec une nette amélioration de l’état de santé. Ils doivent maintenant se confirmer chez l’homme.
L’amyotrophie spinale est une maladie rare d’origine génétique. Elle touche 1 à 9 individus pour 100.000. Elle est due à une dégénérescence des motoneurones dans la moelle épinière qui entraine une perte musculaire progressive. Les symptômes apparaissent le plus souvent après la naissance, avec l’impossibilité d’acquérir le port de tête; ou un peu plus tard dans la petite enfance, avec l’impossibilité de marcher. Plus rarement, les symptômes apparaissent à l’adolescence avec des troubles musculaires importants mais compatibles avec une vie à peu près normale.
La maladie est causée par une mutation sur le gène SMN1 qui entraine un déficit en protéine SMN. C’est alors le gène SMN2, quasiment identique, qui prend le relai mais il produit en majorité une protéine SMN tronquée peu fonctionnelle.
Un problème d’adressage de la protéine SMN
Chez les individus sains, la protéine SMN est attirée dans des structures du noyau de la cellule appelées corps de Cajal. Y sont formés de petits ARN non codants, impliqués dans une étape de maturation des ARN messagers (l’épissage), précurseurs des protéines. Dans l’amyotrophie spinale, les protéines SMN tronquées ne parviennent pas à rejoindre les corps de Cajal, ces derniers fonctionnent mal et la fabrication des petits ARN non codants est altérée. Ainsi, de nombreux ARN messagers présentent des problèmes de maturation et aboutissent à des protéines anormales ou déficientes et cela dans tous les tissus.
Pour tenter de restaurer ce mécanisme chez les malades, les chercheurs ont testé des molécules à visée thérapeutique in vitro, sur des cellules issues de patients atteints de la forme sévère de la maladie. L’objectif était d’en trouver une ou plusieurs capables de réacheminer les protéines SMN vers les corps de Cajal pour qu'ils retrouvent leur fonctionnalité.
La flunarizine efficace sur des cellules provenant de différents patients
Une seule molécule a démontré un effet sur un grand nombre de cellules de patients différents : la flunarizine, déjà utilisée dans le traitement de la migraine et de l’épilepsie.
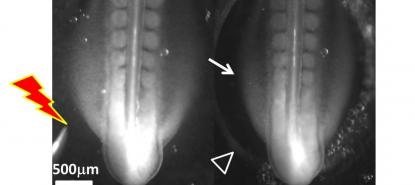
Dans un second temps, des souris malades ont été traitées dès la naissance avec cette molécule, à raison d’une injection par jour au niveau de la moelle épinière. L’espérance de vie des animaux traités a augmenté de 40% en moyenne, passant de 11 à 16 jours et même jusqu'à 36 jours pour l'un de sujets. L’analyse des motoneurones et des muscles montre qu’ils sont préservés plus longtemps chez les animaux traités. « La molécule présente un effet neuroprotecteur important bien que l’on ne se sache pas encore expliquer pourquoi », déclare Suzie Lefebvre, responsable de ces travaux et membre de l’équipe ayant découvert en 1995 le gène responsable de l’amyotrophie spinale infantile. En outre, son équipe a constaté que la flunarizine permettait de rétablir le fonctionnement des petits ARN non codants fabriqués dans les corps de Cajal pour la maturation des ARN messagers.
Des résultats à confirmer chez l’homme
Reste à tester la flunarizine chez l’homme mais cette étape se heurte à la difficulté de recruter des patients dans le cadre d’une maladie rare. En outre, la plupart d’entre eux sont déjà inclus dans un essai clinique d’évaluation d’un médicament de nouvelle génération ayant obtenu une autorisation de mise sur le marché en décembre 2016 et ne peuvent donc pas être mobilisés pour un second essai. A terme, les deux approches thérapeutiques qui ciblent des mécanismes différents, pourraient tout à fait devenir complémentaires pour favoriser la survie et la qualité de vie des patients.
Contact chercheur
Suzie Lefebvre
Unité Inserm 1124 Toxicologie, pharmacologie et signalisation cellulaire
Equipe « Dégénérescence et plasticité Neuromusculaire »
Adresse électronique : suzie.lefebvre@inserm.fr